ÖZGÜN ARAŞTIRMA / ORIGINAL
ARTICLE
Doi: 10.5798/diclemedj.0921.2011.04.0053
Fertil kadınlar ve implantasyon
başarısızlığı olan infertil kadınlarda endometriumun ince yapı ve immünohistokimyasal
değerlendirilmesi
Fine structure and immunohistochemical
evaluation of endometrium in fertile and infertile women with implantation
failure
Leyla Bahar1, Semra Kahraman2, Murat Akkuş3,
Tülin Baykal4
1Mersin Üniversitesi, Sağlık Hizmetleri Meslek
Yüksekokulu, Mersin, Türkiye
2Memorial Hospital
Assisted Reproduction
Technologies & Genetics Center, İstanbul, Türkiye
3Dicle Üniversitesi, Tıp
Fakültesi, Histoloji ve Embriyoloji AD, Diyarbakır, Türkiye
4Mersin Üniversitesi, Tıp
Fakültesi, Histoloji ve Embriyoloji AD, Mersin, Türkiye
Yazışma Adresi / Correspondence: Dr. Leyla Bahar, Gülnaz
Öner Sağlık Hizmetleri Meslek Yüksekokulu, Karaduvar-Mersin, Türkiye
E-mail: laylabahar@gmail.com
Geliş Tarihi / Received: 10.10.2011, Kabul Tarihi
/ Accepted: 23.12.2011
ÖZET
Amaç: Endometrial reseptivite; endometrium epitelinin fonksiyonel başarısı olan geçici bir süreçtir.
Bu çalışmada, fertil ve Tekrarlayan implantasyon başarısızlığı (TİB) olan bireylerin endometrium dokuları, Transmisyon Elektron Mikroskobuyla
(TEM) ve E-cadherinle immünohistokimyasal
açıdan değerlendirilmiştir. Amacımız, sadece fertil
ve TİB olan kadınların endometrium dokularının
karşılaştırılmasını yapmak değil aynı zamanda endometriumda
implantasyon sürecinin hücresel çatısı ve mekaniğinin
daha iyi anlaşılmasını sağlamaktır.
Gereç ve yöntem: Araştırmamız için İn vitro fertilizasyon (İVF)/ Embriyo Transferi (ET) sonrası gebelik
oluşmayan onyedi infertil
ve on fertil kadın çalışmamıza dahil
edilmiştir. Rutin ışık mikroskobu ve TEM teknikleriyle doku takibi
sağlanmıştır.
Bulgular: Fertil grubun endometrium yüzey epitelinde implantasyon belirteci pinopod
oluşumuna yoğun olarak rastlanırken, infertil grupta
yetersiz pinopod oluşumu ve belirgin silya ve mikrovillus varlığı
dikkat çekmektedir. E-cadherinle yapılan immünohistokimya çalışmasında skorlanma
yapılmıştır. Fertil grup epitelinde
immünreaktivite çok belirsizken, infertil
grupta daha belirgin bir boyanma olduğu gözlenmiştir.
Sonuç: Son bulgular E-cadherinin reseptif dönemdeki endometrial epitele yapıştırıcı özellikler aktarıyor olması yanısıra, ikili fonksiyona sahip olması üzerinedir. İlk
aşamalarda, hücre yüzeyinde yapışkanlık sağladığı, daha sonra epitel hücrelerde ayrılma yaptığı ve blastosistin
invazyonunu etkinleştirmek için suprese
olduğu düşünülmektedir. Bu çalışmada TİB grubunun aksine, fertil
grup epitelinin, çok zayıf boyanması, blastosist implantasyonunu
kolaylaştırması açısından önemlidir.
Anahtar kelimeler: E-cadherin,
endometrium, immünohistokimya,
implantasyon
ABSTRACT
Objectives: Being a temporary process, endometrial
receptivity is the functional success of endometrial process. In this study,
the fertile and recurrent implantation failure (RIF) of individuals with
endometrial tissues is analyzed by Transmission Electron Microscopy (TEM) and
immunohistochemistry using the E-cadherin. Our goal is not only to make a
comparison of endometrial tissues in women with RIF and fertile but also to
provide a better understanding of the process and mechanics of the cellular
roof during the implantation of endometrium.
Materials and methods: Our research consists of seventeen infertile
women who are after In-Vitro fertilization (IVF) / embryo transfer (ET) not
occur on pregnancy and ten fertile women were included. Tissue follow-up were
performed using routine light microscopy and TEM techniques.
Results: In fertile group, markers of endometrial
implantation in the surface epithelium, which are pinopodes were found in heavily. In infertile group,
there was prominent cilia formation, microvillus and the presence of inadequate
pinopod. E-cadherin using immunohistochemistry study
was scoring. When immune-reactivity was very pale in the epithelium of the
fertile group, infertile groups showed a clear staining.
Conclusion: Recent findings; E-cadherin transmits adhesive
properties to receptive period of endometrial epithelium as well as, having
dual functions. Firstly, the cell surface adhesion is provided, then the
separation of epithelial cells and is thought to be suppressed to enable the
invasion of the blastocyst. Unlike TIB group, weak staining of epithelium of
the fertile group, is important to facilitate
implantation of the blastocyst.
Key words: E-cadherin, endometrium, immunohistochemistry,
implantation.
GİRİŞ
İmplantasyon, insan endometrium dokusuna
özel bir süreçtir. Endometrium implantasyon
penceresi olarak adlandırılan zaman dilimi içinde embriyoyu kabul eder.1
İmplantasyon, döllenmeyi
takiben embriyonun endometriuma gelmesi ve burada
zonasından sıyrılması sonrasında gerçekleşir. İnsanda embriyo yaklaşık ovulasyon sonrası +6 günde, blastosist
haline geldikten sonra implantasyon sürecine girer.
Diğer canlı türlerinden farklı olarak, IVF siklüslerinden
elde edilen sonuçlara göre insan embriyosu 6-8 hücre iken implantasyon
yeteneği kazanabilmektedir. İmplantasyon
gerçekleşmeden önce endokrin, otokrin ve parakrin mesajlarla, endometrium
ve embriyo implantasyon için hazırlanır ve uygun
ortam sağlanır.2
Endometriumda çeşitli yapısal, hücresel ve moleküler olaylar dizisi implantasyon
penceresi ile kontrol edilir ve bu durumun sonucunda endometrial
reseptiviteyi sağlayan gerekli elemanlar ortaya
çıkabilir.3 Blastosistler, endometrial epitel ile sadece implantasyonun pencere döneminde etkileşime girebilirler.1
Bunu belirleyen ise, korpus luteumdan
salgılanan progesteronun, endometriumdaki
etkileri ve bunları takip eden gebeliğin 4. günündeki küçük bir östrojen
pikidir.3-4 İmplantasyon penceresi
sırasında, endometrium epitel
hücrelerinin plazma zarı bir dizi değişikliğe uğrar.5 Birçok memeli
türünde, epitel hücrelerinin apikal
yüzeyinde geniş yuvarlak, projeksiyon görünümünde
yapılar mevcuttur.6-7 Endometriumun reseptif faza ulaşması için ve gebeliğin oluşmasında progesteron esastır.8 Reseptivite
fazında; embriyonun yaklaşması, tutunması ve penetrasyonuna
izin veren endometriyumda aynı zamanda desidualizasyona giden stromal değişiklikler
meydana gelir.9 İmplantasyon yetersizliği,
IVFun başarısını sınırlayan önemli faktörlerden
biridir. Bir blastosist, implantasyonun
başlangıcı için reseptivite kazanmış bir endometriumla etkileşime ihtiyaç duyar.10 IVFun başarısı bunların uyumlu gelişimine bağlıdır.
Tekrarlayan İmplantasyon Başarısızlığının altında,
embriyo ve endometrium bağlantılı problemler olduğu
ileri sürülmektedir.11
Başarılı implantasyonun ön koşulu olarak, reseptif endometriumun
hazırlanması ve blastosistin implantasyonunda
önemli rol oynayan molekül etkileşimler, karmaşık bir kaskad
içerir.8 Bu konuda belirlenen moleküller; sitokinler,
büyüme faktörleri, matriks metalloproteinazları
(MMP), adezyon molekülleri, ekstrasellüler
matriks komponentleri ve homeoboks element içeren genlerdir.12 E-cadherin, ağırlıklı olarak epitel
dokulardan eksprese olan kalsiyum bağımlı hücre adezyon molekülüdür. Doku
mimarisinin kontrolü ve bütünlüğünün korunması ile hücrelerin büyüme ve
gelişiminde önemli bir rol oynar.
GEREÇ VE YÖNTEM
Çalışmamıza, 17 TİB olan ve 10
fertil kadın dahil
edilmiştir. Vaka grubu olarak, İstanbul Memorial
Hastanesi Yardımcı Üreme Teknikleri ve Genetik Tanı Merkezine infertilite nedeniyle başvuran ve TİB endikasyonu
konan toplam 17 ve 10 kontrol bireyin endometriumlarından
alınan biyopsi örnekleri toplandı. Biyopsi örneklemesi yapılmadan önce bireyler
detaylı şekilde bilgilendirildi ve onamları alındı. Bu çalışma İstanbul Memorial Hastanesi Etik Kurulu tarafından onay alınarak
yapıldı. Endometrial doku örneklerine TEM ve immünohistokimyasal analiz yapılmak amacıyla rutin doku
takibi uygulanmıştır.
Elektron mikroskop doku takibi
Elektron mikroskobik inceleme
için alınan dokular, öncelikle, kan, mukus, akıntı sıvısından temizlenmek
üzere, hassasiyetle 100IU/ml penisilin, 0.1mg/ml streptomisin ve 0.25µg/ml amfoterisin içeren Earlys Balanced Salt Solution (EBSS) ile birkaç kez yıkandı. Tesbit edilmek üzere, 1 mm³lük parçalara bölündü ve 1. tesbit solüsyonumuz olan % 2.5luk
hazırlanan gluteraldehitte, yaklaşık 4-6 saat tesbit edilen dokular, tampon solüsyonu içine alınarak
yıkandı (3x10 dak.) sonrasında yeni tampona alındı.
Ertesi gün tamponu uzaklaştırılan dokular, ikinci tesbit
solüsyonu içine kondu. (%1lik osmium tetroksit, 1,5 saat). Tesbit
işleminin ardından PHyı nötralize
ederek doku hasarını en aza indirgemek için, dokular tamponda
bekletildi. Dehidratasyon için, artan oranlarda etil
alkole konuldu (% 30, % 50, % 70, % 90, %100, %100 etil alkol X10dak.). Geçiş
sıvısı olarak propilen oksit kullanıldı (2X15 dak. rotatorda). Propilen oksit ve gömme
materyalinin aşamalı olarak dokulara infiltrasyonunu
sağlamak üzere, propilen oksit ve rezin
karışımları uygulandı. Gömme Materyali için Araldite
(CY212 R1030) kullanıldı. Ertesi gün dokular polietilen kapsüllere gömüldü ve
60 ºC etüvde 36 saat bırakılarak, polimerizasyonu
sağlandı. Doku bloklarından, ultramikrotom (Leica Ultracut) ile cam bıçak
kullanılarak ortalama 70 nm kalınlıkta kesitler elde
edildi ve bakır gridlere alındı. Kesitler, kontrastlandıktan sonra incelenmek üzere transmisyon
elektron mikroskobu (Jeol 1011) ile değerlendirildi.
İmmünohistokimya doku takibi
Dokuların immünohistokimyasal
açıdan değerlendirilmesinde E-cadherin kullanıldı.
Lamlara alınan doku kesitleri, 55°Cde bir gece, 65°Cde bir saat bekletildi, deparafinizasyon ve dehidratasyon
işlemleri uygulandı, sonraki aşamalarda distile suda
ve fosfat tuz tamponunda (PBS, pH: 7.2-7.4)
yıkanması sağlandı. Antijenik maskelenmenin
oluşmaması için doku kesitleri, sodyum sitrat tamponu
(0.01M, pH: 6.0, 978 ml dH2O
için de 2.94 gr trisodyum sitrat
ve 22 ml HCl) içinde mikrodalga fırında işlem gördü
(2X3 dak. ). Sonra PBSden
geçirilerek hidrojen peroksid (Biogenex
HK 111-5K, %3) uygulandı. PBSde yıkanan kesitler primer antikorlarıyla bir gece inkübe
edildi (oda ısısı ve nemli ortam). PBSden geçirilen
kesitlere sırasıyla 30ar dakika biyotinli sekonder antikor human E-cadherin (Zymed, San Francisco,
CA) ve streptavidin-peroksidaz kompleksi
uygulandı. Tekrar PBSden geçirilen kesitler,
İstatistiksel Analiz
Kesitler, Nikon
Eclipse 80i ışık mikroskobunda incelendi. İmmünreaktivite yoğunluğu 0.5 (Çok zayıf ), 1 (Zayıf), 2
(Orta dereceli), 3 (Güçlü) gruplarında yarı kantitatif
olarak aynı araştırmacı tarafından değerlendirildi. İmmünreaktif
hücre yüzdesi ortalama 100-300 hücre sayılarak elde edildi. İmmünreaktif
hücre yok ise skor 0, %10 pozitif hücre skor 1, %10-50 skor 2, %51- 80 skor 3,
%80 ve üzeri skor 4 olarak değerlendirildi. İmmüno Histokimyasal Skor (İHS); literatüre göre immünreaktif hücre sayı skoru ile yarı kantitatif
immünoreaktivite yoğunluğu değerlerinin çarpımı
sonucunda elde edildi.13-14
BULGULAR
Fertil ve TİB grubu endometrium dokusunun elektron
mikroskobik değerlendirilmesi
Fertil grubun endometrium yüzey epitel hücreleri incelendiğinde; salgı vakuolleri
ve salgı içeriğiyle dolu pinopod adı verilen sitoplazmik uzantılar gözlendi. Lümen içinde salgı
materyali olarak, hücrelerle bağlantısını yitirmiş sitoplazmik
uzantı (pinopod) parçaları bulunmaktaydı. Salgı vakuollerinin daha yoğun olarak hücrelerin supranuklear bölgelerinde yer aldığı gözlendi (Şekil 1a).
Tekrarlayan implantasyon başarısızlığı grubu endometrial doku örneklerinde ise; Endometriumun
yüzey epitelinin alçak silindirik hücrelerden
oluştuğu gözlendi. Çoğu hücrelerin apikalinde çok
sayıda düzensiz mikrovilluslar vardı, bu hücrelerin
arasında daha seyrek olarak silyuma sahip hücrelere
rastlandı. Lümene yakın alanlarda salgı vakuolleri de
bulunmasına rağmen sağlıklı pinopod yapısı
oluşturamadıkları gözlendi. Lümene doğru az miktarda pinopod
benzeri yapı bulunuyordu. Yüzey epitel hücrelerinin
sitoplazmasında gelişigüzel dağılmış salgı vakuolleri
vardı (Şekil 1b).
Tablo 1. Fertil
ve tekrarlayan implantasyon başarısızlığı (TİB)
gruplarının yüzey ve bez epitellerinde E-kadherin immünreaktivitesinin
değerlendirilmesi.
|
N |
Ortalama |
Standart Sapma |
||
|
Yüzey epitel |
Fertil |
6 |
0,9500 |
0,54314 |
|
TİB |
6 |
2,6833 |
0,31885 |
|
|
Bez epitel |
Fertil |
6 |
1,9667 |
0,38297 |
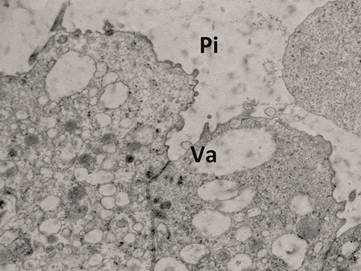
Şekil 1a. Fertil
grup endometriyal yüzey epiteli
X20000
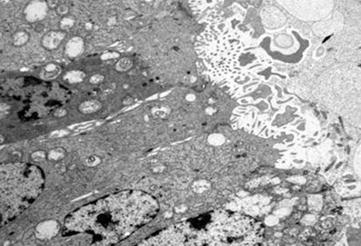
Şekil 1b. TİB grubu endometriyal
yüzey epiteli X7500
Va: vakuol, Pi: pinopod, Mi: Mitokondri, Beyaz ok: Mikrovillüs,
Siyah ok: Silya.
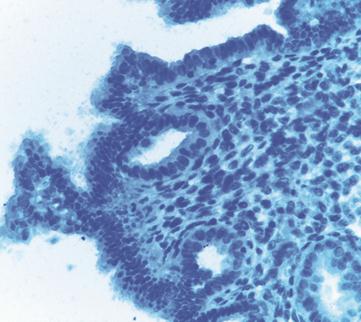
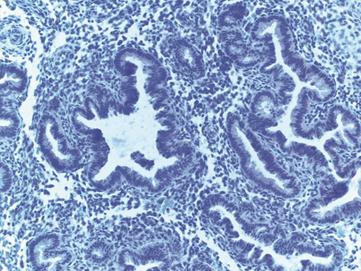
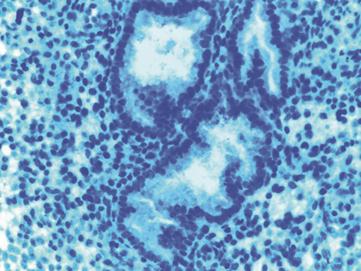
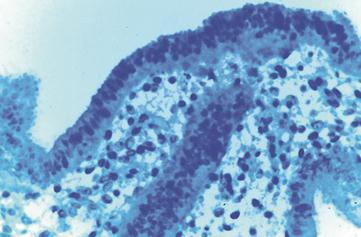
Şekil 2a ve 2b. (üstte) sırasıyla Fertil ve TİB grubun endometriyum
dokusu yüzey epiteli X20, X40.
Şekil 3a ve 3b. (altta) sırasıyla Fertil ve TİB grubun bez epitel
lümenindeki immünreaktif boyanma.Beyaz ok; yüzey epitelinde,
kıvrıml ok; bez lümen epitelinde
boyanma X20, X40.
Fertil ve TİB grubu endometrium dokusunun immünohistokimyasal değerlendirilmesi
Bu grupların ışık mikroskobik
olarak değerlendirilmesinde fertil grubun endometrium epitel hücrelerinde immünohistokimyasal açıdan E-cadherinin
immünreaktivitesi değerlendirilmiştir (Tablo 1). Fertil grup endometrium dokusu
yüzey epitelinde, E-cadherin
ile IHS skorlamasına göre yok veya çok zayıf boyanma
olmasına rağmen (Şekil 2a), bez epitelinin daha
belirgin olarak ve IHS skorlamasına göre orta boyanma
gösterdiği gözlenmiştir (Şekil 3a). TİB grubunun E-cadherin
immünreaktivitesi açısından değerlendirilmesinde; endometrium yüzey epitelinde orta
düzeyde boyanma gösterdiği (Şekil 2b), bez epitelinde
ise boyanmanın zayıf olduğu belirlenmiştir (Şekil 3b).
İstatiksel Analiz
İstatistiksel analizler SPSS 11.5 paket programında yapılmıştır. Verilerin normal dağılım
göstermesi nedeniyle Independent-Samples T testi
yapılmıştır. Fertil ve TİB grubu endometrial
yüzey epitelleri E-cadherin
için karşılaştırıldığında istatistiksel farklılık bulunmuştur (p<0,001). Fertil ve TİB grubu bez epitelleri
de E-cadherin için karşılaştırıldığında p=0,009
olarak bulunmuş olup, istatistiksel açıdan anlamlı olduğu tesbit
edilmiştir.
TARTIŞMA
Bugüne kadar yapılan
çalışmalar sonucunda implantasyon ve gebelik
oranlarını etkileyen başlıca faktörler arasında oosit, embriyo kalitesi ve endometrium yer almaktadır.15 Üremeye Yardımcı
Tekniklerle ilgilenen uzmanların IVF başarısızlıklarında altta yatan nedeni,
kötü embriyo kalitesine bağlama eğilimleri oldukça fazladır. Oysa embriyolojik
faktörler yanında, implantasyon problemine yol açan
kötü endometrial reseptivite
gibi birçok faktör IVF başarısını etkileyebilir.16-17 Yetersiz endometrial reseptivite, implantasyon başarısızlığının yaklaşık üçte ikisinden
sorumludur.18 IVFda tekrarlayan implantasyon başarısızlığı kompleks
bir konudur ve henüz tamamen anlaşılamamıştır.19
İmplantasyon; blastosist
ve endometrial tabakalar arasında kendiliğinden
gelişen dinamik bir süreç olmasına rağmen, implantasyon
penceresi boyunca endometriumun hazırlanması tamamen maternal kaynaklıdır. Aksine sağlıklı kadın infertilitesinin en büyük sebebi, üreme tıbbında henüz
çözümlenememiş olan implantasyon başarısızlığıdır. TİBnın tanımı; ardışık üç IVF/ICSI-ET siklusunda
veya toplam 10 adet iyi kalitede embriyonun transferini takiben gebelik
oluşmaması olarak kabul edilmektedir.20 Reseptif
periyotta, hormonlarla kontrol edilen endometrial epitel hücrelerinde, moleküler anlamda da bazı
değişiklikler oluşur ve hücre yüzey değişiklikleriyle birlikte, glikokaliksin kalınlığında azalma meydana gelir.21-,23
Apiko-bazal polarite kaybı olmaksızın eş zamanlı olarak epitel
hücre adezyon moleküllerinde kayıp oluşur. Ancak apikal hücre-hücre etkileşimi ve endometrium
epiteliyle trofoblast
arasında bir yakınlaşma meydana gelir.24-25 İmplantasyonla
ilgili olarak, bizim de kullandığımız E-cadherin, en
çok çalışılan bir alt sınıfı temsil eder. Epitel
plazma membranlarının lateralindeki
ara bağlantılar (adherens junction)
denilen özel bölgelerde lokalize olduğu bilinmektedir.
E-cadherin ekspresyonunun bastırılması, temel moleküler
olaylarda hücre-hücre adezyonunun engellenmesine neden olabilir. Fare embriyo implantasyonunda yapılan çalışmalar göstermiştir ki, E-cadherin genlerinde oluşturulan mutasyonlar, preimplantasyon sürecinde defektler
oluşturmaktadır.26 İnsan embriyosunun implantasyonunda
E-cadherinin rolü bilinmiyor, ancak bu süreç için E-cadherin ekspresyonunun önemi bilinmektedir. Luteal faz boyunca E-cadherin mRNA seviyelerinde artış gözlenmektedir.27 Dawood, Poncolet ve arkadaşları
tarafından, bu menstrual siklus
değişikliklerinin, immünohistokimyasal çalışmalarla
protein seviyesinde tesbit edilmediği
belirtilmektedir.28-29 Bizim çalışmamızda fertil
ve TİB olan kadınların endometrium dokularının, E-cadherinin ekspresyonu açısından değerlendirilmesi
sağlanmıştır. E-cadherinin regülasyonu,
hücreler arası kalsiyum tarafından yapılır. Kalsiyumdaki artış, ara
bağlantılardaki E-cadherinin dağılımına ve hücre
iskeletinin yeniden organize olmasını sağlayan, anahtar sinyal yolaklarının
aktive olmasına yol açar. Hücreler arası kalsiyum konsantrasyonundaki
değişiklikler, hücre adezyon moleküllerinin yeniden
yapılanmasını tetikler ve bu durumdan epitel
hücrelerinin yapışıklık ve polaritesi etkilenmektedir.30 Bu
çalışmada da fertil ve TİB grubu bireylerin endometrium dokularının E-cadherin
açısından farklı sonuçlar vermesi bu durumu doğrulamaktadır. Li ve
arkadaşlarının kültüre edilmiş Ishikawa hücreleriyle
yaptığı çalışmada, hücreler arası kalsiyum artışı, kalsitonini
tetikleyerek, E-cadherin ekspresyonunun hücresel
bağlantı bölgelerinde suprese edildiğini ortaya
koymuşlardır.31 Sekretuar faz boyunca
insan endometrial epitelinde
artan progesteron nedeniyle kalsitonin
seviyesinin artması dikkat çekicidir.32 Bizim çalışmamızda da, sekretuar fazda alınan fertil
grup endometrial dokularının yüzey epitelinde E-cadherinle boyanma
yok veya çok zayıf şeklinde tesbit edilmiştir (Şekil
2a). Oysa TİB grubunda E-cadherinle homojen
olarak daha belirgin bir immünreaktivite gözlenmiştir
(Şekil 2b). Fertil grubun bez epitelinin
boyanmasını TİB grubuyla karşılaştıracak olursak, Fertil
grupta belirgin boyanma gözlenmiş olup, istatiksel olarak anlamlı bir fark tesbit edilmiştir (Şekil 2b,3b).
Özellikle insan endometrial epiteli
progesteron tarafından indüklenir. Progesteron belki de, endometrial
kalsitonon indüksiyonu yoluyla hücreler arası
kalsiyumu artırabilir ve E-cadherin ekspresyonunu regüle edebilir.33 Bu durumda E-cadherinin ikili fonksiyona sahip olması ihtimali
mümkündür. İlk aşamalarda, hücre yüzeyinde eksprese olması yapışkanlık sağlamak
için gereklidir. Buna karşılık, daha sonra E-cadherinin
epitel hücrelerde ayrılma yaptığı ve blastosistin invazyonunu
etkinleştirmek için suprese olduğu düşünülmektedir.
Çalışmamızda fertil grup yüzey epitelinin
E-cadherin için yok veya çok zayıf boyanması, burada
bahsedilen düşünceyle de doğrulanmaktadır.
E-cadherin, hücre-hücre arası etkileşimde önemli
olan, Ca bağımlı, transmembran
glikoprotein ailesidir. Bu ailenin üyeleri çeşitli
dokularda farklı olarak eksprese olurlar. Tip 1 ve tip 2 şeklinde subgrupları olan cadherinler endometrial epitelde doku
bütünlüğü ve morfogenezi sağlayan önemli bir
moleküldür. Başarılı implantasyon, yaşam için kritik
olduğundan dolayı, endometrial reseptivite
için büyük olasılıkla birden fazla ve dinamik mekanizmalar var olabilir. Ayrıca
bu fonksiyonda bulunan, bazı kritik genlerin yer aldığı düşünülmektedir. İmplantasyondaki moleküller ve eylem mekanizmalarının
tanımlanması, implantasyon sürecinin daha iyi
anlaşılmasını sağlayacaktır. Son bulgular E-cadherinin
reseptif dönemdeki endometrial
epitele yapıştırıcı özellikler aktarıyor olduğu
üzerinedir. E-cadherin ekspresyonunun, AN3-CA
hücrelerinde epigenetik olarak düzenlenmesi endometrial reseptiviteyi kontrol
eden bir mekanizmadır.34-35 Bu epigenetik
düzenleme mekanizması, doğum kontrolünü geliştirme ya da yardımcı üreme
tekniklerinde başarı oranının artırılması için yeni terapötik
hedeflerin belirlenmesinde kritik bir ilk adım olabilir. E-cadherinin
insan endometrial reseptivitesinin
gelişmesinde anahtar rol oynadığı ve biyolojik olaylarda önemli bir faktör
olduğu düşünülmektedir. Ancak, bunun aydınlatılması için daha ileri çalışmalara
ihtiyaç vardır.
KAYNAKLAR
1. Susan JK. Molecular
interactions at the maternal-embryonic interface during the early phase of
implantation. Sem Reprod
Med 2000;18(3):237-43.
2. Attar E. Spermatogenezis, Fertilizasyon,
Erken embriyo gelişimi ve İmplantasyon. Umur Çolgar. Reproduktif Endokrinoloji
ve İnfertilite, 1. baskı. İstanbul: İstanbul Medikal
Yayıncılık, 2006:34-45.
3. Paria BC, Lim H, Wang XN, Liehr
J, Das SK, Dey SK. Coordination of different effects
of primary estrogen and catecholestrogen on two
distinct targets mediates embryo implantation in the mouse. Endocrinology 1998;139(12):5235-46.
4.
Sunder S, Lenton E. Endocrinology of the Peri- Implantation Period. Clin Obstet Gynaecol 2000;14(5):789-800.
5.
Murphy CR, Shaw TJ. Plasma membrane transformation: a common response of
uterine epithelial cells during the peri-implantation
period. Cell Biol Int 1994;18(12):1115-28.
6.
Murphy CR. Junctional barrier complexes undergo major
alterations during the plasma membrane transformation of uterine epithelial
cells. Hum Reprod 2000;15(3):182-8.
7. Salmani MK, Nikzad H, Shiokawa S, Akimoto Y, Iwashita M. Secretory role for human
uterodomes (pinopods):
secretion of LIF. Mol Hum Reprod
2005;11(8):5539.
8. Rashid NA, Lalitkumar
S, Lalitkumar PG, Gemzell-Danielsson
K. Endometrial Receptivity and Human Embryo Implantation. Am J Reprod
Immunol 2011;66(1):2330.
9. Defrere S, Langendonck A, Moulin
P, et al. Human endometrial epithelial cells (EEC) contitutively
express more intercellular adhezion molecule (ICAM)-1
than endometrial stromal cells (ESC) in culture. Am J Reprod
Immunol 2005;54(1):5-12.
10. Nikas G, Develioglu OH, Toner JP,
Jones HW. Endometrial pinopodes indicate a shift in
the window of receptivity in IVF cycles. Hum Reprod
1999;14(3):78792.
11.
Tan BK, Vandekerckhove P, Kennedy R, Keay SD. Investigation and current management of recurrent
IVF treatment failure in the UK. BJOG 2005;112(6):77380.
12. Dey SK, Das SK, Reese J, Paria
BC, Daikoku T, Wang H.
Molecular cues to implantation. Endocr Rev 2004;25(3):341-73.
13.
Lee CN, Chang SW, Cho NH, Cho SH. Nitrous oxide synthase expression in placenta
of preeclampsia. J Korean Med Sci 1997;12(6):532-8.
14. Mutlu C, Koyutürk M, Karpuz V. Evaluation of endothelial nitric oxide synthase (eNOS) immunreactivity of fetal
and maternal placenta. Cerrahpaşa J Med 2005;36(1):109-15.
15. İltemur
DC, Şatıroğlu H, Berker B, Çetinkaya H, Kahraman K. Yardımla üreme
tekniklerinde implantasyon ve gebelik oranlarını
etkileyen faktörler. T Klin J Gynel
Obst 2003;13(4):466-75.
16. Akar M, Kurşun S, Taşkın
Ö. Tekrarlayan İn vitro Fertilizasyon
Başarısızlıklarında Yaklaşım. Türk Fertil Der
2004;12(3):217-24.
17. Bahar L, Baykal T. İmplantasyon Sürecinde Endometriyum.
Mersin Üniversitesi Sağlık Bilimleri Dergisi 2008;1(2):1-7.
18. Ledee-Bataille N, Lapree-Delage
G, Taupin JL. Concentration of leukaemia
inhibitory factor (LIF) in uterine flushing fluid is highly predictive of
embryo implantation. Hum Reprod 2002;17(1):213-8.
19.
Bee K, Tan BK, Vandekerckhove P, Kennedy R, Keay SD. Investigation and current management of recurrent
IVF treatment failure in the UK. Int J O & G 2005;112(6):773-80.
20.
El-Toukhy T. and Taranissi
M. Towards better quality research in recurrent implantation failure:
standardizing its definition is the first step. Reprod
Biomed Online 2006;12(3):383-5.
21.
Elder K, Dale B. Preimplantation Genetic Diagnosis. In Vitro Fertilization, 2nd edn.
Cambridge: Cambridge University Press, 2000:1-33.
22. Bahar L, Kahraman S, Baykal T.
Comparatively Evaluation of Infertile (RIF) and Fertile Women Endometrial
Biopsies at the Ultrastructural Level by TEM. In: Dubuisson JB, Gomel V. Reproductive Medicine and Surgery
from the Proceedings of the 15th World Congress on In Vitro Fertilization and 4th
World Congress on In Vitro Maturation, 1st edn.
Geneva, Monduzzi International Proceedings,
2009:171-3.
23. Nikas G. Pinopodes as markers of
endometrial receptivity in clinical practice. Hum Reprod
1999;14(2):99-106.
24. Tinel H, Denker HW, Thie M. Calcium influx in human uterine epithelial RL95-2
cells triggers adhesiveness for trophoblast-like
cells. Model studies on signalling events during
embryo implantation. Mol Hum Reprod
2000;6(12):111930.
25. Thie M, Harrach-Ruprecht B, Sauer
H, Fuchs P, Albers A, Denker HW. Cell adhesion to the
apical pole of epithelium: a function of cell polarity. Eur
J Cell Biol 1995;66(2):18091.
26. Bloorl DJ, Metcalfe AD, Rutherford A. Brison
DR. Kimber SJ. Expression of cell
adhesion molecules during human preimplantation
embryo development. Mol Hum Reprod 2002;8(3): 237-45.
27.
Fujimoto J, Ichigo S, Hori M, Tamaya
T. Alteration of E-cadherin, alpha- and beta-catenin mRNA expression in human
uterine endometrium during the menstrual cycle. Gynecol
Endocrinol 1996;10(1):18791.
28. Dawood MY, Lau M, Khan-Dawood FS.
E-cadherin and its Messenger ribonucleic acid in periimplantation
phase human endometrium in normal and clomiphene-treated cycles. Am J Obstet Gynecol 1998;178(5):9961001.
29. Poncelet C, Leblanc M, Walker-Combrouze
F, et al. Expression of cadherins and CD44 isoforms
in human endometrium and peritoneal endometriosis. Acta
Obstet Gynecol Scand 2002;81(3):195203.
30. Gumbiner B, Stevenson B, Grimaldi
A. The role of the cell adhesion molecule uvomorulin
in the formation and maintenance of the epithelial junctional
complex. J Cell Biol 1988;107(4):157587.
31. Li
Q, Wang J, Armant DR, Bagchi
MK, Bagchi IC. Calcitonin down-regulates E-cadherin
expression in rodent uterine epithelium during implantation. J Biol Chem 2002;277(4):44755.
32.
Kumar S, Zhu LJ, Polihronis M, et al. Progesterone
induces calcitonin gene expression in human endometrium within the putative
window of implantation. J Clin Endocrinol
Metab 1998;83(12):444350.
33.
Zhu LJ, Bove KC, Polihronis
M. Calcitonin is a progesterone regulated marker which forecasts the receptive
state of endometrium during implantation. Endocr J
1998;139(9):392334.
34. Rahnama F, Thompson B, Steiner M, et al. Epigenetic
regulation of e-cadherin controls endometrial receptivity. Endocrinology 2009;150(3)146672.
35.
Shih HC, Shiozawa T, Miyamoto T, et al. Immunohistochemical expression of e-cadherin and catenin in
the normal and malignant human endometrium: An inverse correlation between
e-cadherin and nuclear -catenin expression. Anticancer Res 2004;24(8):3843-50.